Определение 1
Алканами называют такие углеводороды, атомы углерода, в молекулах которых соединены между собой простыми (одинарными) $\sigma $- связями. Все остальные единицы валентности атомов углерода в этих соединениях заняты (насыщенны) атомами водорода.
Атомы углерода в молекулах насыщенных углеводородов находятся в первом валентном состоянии, то есть в состоянии $sp3$-гибридизации. Такие насыщенные углеводороды еще называют парафинами .
Парафинами эти органические соединения называют потому, что долгое время их считали малореакцийноспособными (от лат. parum - мало и affinis - имеет сродство).
Старое название насыщенных углеводородов - алифатические или жирные, углеводороды (от лат. alifatic - жирный). Это название происходит от названия первых изученных соединений, которые когда-то относили к этим веществам, - жиров.
Насыщенные углеводороды образуют ряд соединений с общей формулой $C_nH_{(2_n+2)}$ $(n - 1, 2, 3, 4, ...)$. Простой соединением этого ряда является метан $CH_4$. Поэтому ряд этих соединений называют еще рядом метановых углеводородов.
Гомологические ряды
Соединения ряда метана имеют подобные строение и свойства. Такой ряд соединений, представители которого имеют близкие химические свойства и характеризуются закономерной сменой физических свойств, имеют однотипную структуру и отличаются друг от друга на одну или несколько $-CH_2$-групп, называют гомологичным рядом (от греч. «гомос » - сходство). Каждый последующий углеводород данного ряда отличается от предыдущего на группу $-CH_2$. Эта группа называется гомологичной разницей, а отдельные члены этого ряда - гомологами.
Происхождение названий алканов
Названия первых четырех насыщенных углеводородов (метан, этан, пропан, бутан) возникли случайно. Например, корень слова «этан» произошел от латинского слова ether - эфиы, так как остаток этана $-C_2H_5$ входит в состав медицинского эфира. Начиная с $C_5H_{12}$, названия алканов образованы от греческих или латинских числительных, которые указывают количество углеродных атомов в молекуле данного насыщенного углеводорода с добавлением к этим названиям суффикса -ан. Так, углеводород $C_5H_{12}$ называется пентан (от греч. «пента » - пять), $C_6H_{14}$ - гексан (от греч. «гекса » - шесть), $C_7H_{10}$ - гептан (от греч. «гепта » - семь) и т. д.
Правила систематической номенклатуры
Для названия органических веществ комиссией Международного союза теоретической и прикладной химии (IUPAC) были разработаны правила систематической (научной) номенклатуры. Согласно этим правилам, названия углеводородам дают таким образом:
В молекуле углеводорода выбирают основную - длинную и сложную (которая имеет наибольшее число ответвлений) - углеродную цепь.
Нумеруют атомы углерода основной цепи. Нумерацию осуществляют последовательно с того конца цепи, который дает радикалу наименьший номер. Если существует несколько алкильных радикалов, то сравнивают величину цифр двух возможных последовательных нумерации. И нумерация, в которой первой встречается меньше цифра, чем во второй последовательной нумерации, считается «меньше» и используется для составления названия углеводорода.
Нумерация справа налево будет «меньше», чем нумерация слева направо.
Называют углеводородные радикалы, которые образуют боковые цепи. Перед названием каждого радикала ставят цифру, которая указывает номер углеродного атома главной цепи, у которого с находится данный радикал. Цифру от названия отделяют дефисом. Названия алкильных радикалов перечисляют в алфавитном порядке. Если углеводород имеет в своем составе несколько одинаковых радикалов, то записывают в порядке возрастания номера углеродных атомов, у которых стоят эти радикалы. Цифры отделяют друг от друга запятыми. После цифр записывают префиксы: ди- (если одинаковых радикалов два), три- (когда одинаковых радикалов три), тетра-, пента- и т. д. (если одинаковых радикалов соответственно четыре, пять и т. д.). Префиксы указывают, сколько одинаковых радикалов имеет данный углеводород. После префикса ставят название радикала. В том случае, если два одинаковых радикалы находятся у одного углеродного атома, номер этого атома углерода ставится в названии дважды.
Называют углеводород основной пронумерованной углеродной цепи, помня при этом, что названия всех насыщенных углеводородов имеют суффикс -ан.
Приведенный ниже пример поможет уяснить эти правила:
Рисунок 1.
Алкильные радикалы боковых цепей
Иногда алкильные радикалы боковых цепей разветвленные. В этом случае их называют так, как соответствующие насыщенные углеводороды, только вместо суффикса -ан принимают суффикс -ил.
Углеродную цепь разветвленного радикала нумеруют. Атом углерода этого радикала, соединенный с основным цепью, получает номер $1$. Для удобства углеродную цепь разветвленного радикала нумеруют цифрами со штрихами и полное название такого радикала берут в скобки:

Рисунок 2.
Рациональная номенклатура
Кроме систематической для названия насыщенных углеводородов используют еще рациональную номенклатуру. По этой номенклатуре насыщенные углеводороды рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на радикалы. Название насыщенного углеводорода по рациональной номенклатуре образуют таким образом: называют по степени сложности все радикалы, которые находятся у атома углерода с наибольшим количеством заместителей (отмечая их количество, если они одинаковые), а затем добавляют основу названия углеводорода по этой номенклатуре - слово «метан». К примеру:
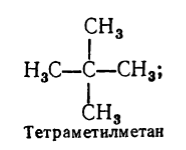
Рисунок 3.
Рациональную номенклатуру пользуются для названия сравнительно простых углеводородов. Эта номенклатура не так усовершенствована и гораздо менее удобна в пользовании по сравнению с систематической номенклатурой. По рациональной номенклатуре одно и то же вещество может иметь разные названия, что очень неудобно. Кроме того, по данной номенклатуре можно назвать далеко не все насыщенные углеводороды.
Нелишне будет начать с определения понятия алканов. Это насыщенные либо предельные Также можно сказать, что это углероды, в которых соединение атомов C осуществляется посредством простых связей. Общая формула имеет вид: CnH₂n+ 2.
Известно, что соотношение количества атомов H и C в их молекулах максимально, если сравнивать с другими классами. Ввиду того что все валентности заняты либо C, либо H, химические свойства алканов выражены недостаточно ярко, поэтому их вторым названием выступает словосочетание предельные либо насыщенные углеводороды.
Также существует более древнее наименование, которое лучше всего отражает их относительную химинертность - парафины, что в переводе означает «лишенные сродства».
Итак, тема нашего сегодняшнего разговора: «Алканы: гомологический ряд, номенклатура, строение, изомерия». Также будут представлены данные касательно их физических свойств.
Алканы: строение, номенклатура
В них атомы C пребывают в таком состоянии, как sp3-гибридизация. В связи с этим молекулу алканов можно продемонстрировать в качестве набора тетраэдрических структур C, которые связаны не только между собой, но и с H.
Между атомами C и H присутствуют прочные, весьма малополярные s-связи. Атомы же вокруг простых связей всегда вращаются, ввиду чего молекулы алканов принимают разнообразные формы, причем длина связи, угол между ними - постоянные величины. Формы, которые трансформируются друг в друга из-за вращения молекулы, происходящего вокруг σ-связей, принято называть ее конформациями.

В процессе отрыва атома H от рассматриваемой молекулы сформировываются 1-валентные частицы, называемые углеводородными радикалами. Они появляются в результате соединений не только но и неорганических. Если отнять 2 атома водорода от молекулы предельного углеводорода, то получатся 2-валентные радикалы.
Таким образом, номенклатура алканов может быть:
- радиальной (старый вариант);
- заместительной (международная, систематическая). Она предложена ИЮПАК.
Особенности радиальной номенклатуры
В первом случае номенклатура алканов характеризуется следующим:
- Рассмотрение углеводородов в качестве производных метана, у которого замещен 1 либо несколько атомов H радикалами.
- Высокая степень удобства в случае с не очень сложными соединениями.
Особенности заместительной номенклатуры
Заместительная номенклатура алканов имеет следующие особенности:
- Основа для названия - 1 углеродная цепь, остальные же молекулярные фрагменты рассматриваются в качестве заместителей.
- При наличии нескольких идентичных радикалов перед их наименованием указывается число (строго прописью), а радикальные номера разделяются запятыми.
Химия: номенклатура алканов
Для удобства информация представлена в виде таблицы.
Название вещества | Основа названия (корень) | Молекулярная формула | Название углеродного заместителя | Формула углеродного заместителя |
Вышеуказанная номенклатура алканов включает названия, которые сложились исторически (первые 4 члена ряда предельных углеводородов).
Наименования неразвернутых алканов с 5 и более атомами C образованы от греческих числительных, которые отражают данное число атомов C. Так, суффикс -ан говорит о том, что вещество из ряда насыщенных соединений.

При составлении названий развернутых алканов в роли основной цепи выбирается та, которая содержит максимальное количество атомов C. Она нумеруется так, чтобы заместители были с наименьшим номером. В случае двух и более цепей одинаковой длины главной становится та, которая содержит наибольшее количество заместителей.
Изомерия алканов
В качестве углеводорода-родоначальника их ряда выступает метан CH₄. С каждым последующим представителем метанового ряда наблюдается отличие от предыдущего на метиленовую группу - CH₂. Данная закономерность прослеживается во всем ряду алканов.
Немецкий ученый Шиль выдвинул предложение назвать этот ряд гомологическим. В переводе с греческого означает «сходный, подобный».
Таким образом, гомологический ряд - набор родственных органических соединений, имеющих однотипную структуру с близкими химсвойствами. Гомологи - члены данного ряда. Гомологическая разность - метиленовая группа, на которую отличаются 2 соседних гомолога.
Как уже упоминалось ранее, состав любого насыщенного углеводорода может быть выражен посредством общей формулы CnH₂n + 2. Так, следующим за метаном членом гомологического ряда является этан - C₂H₆. Чтобы вывести его структуру из метановой, необходимо заменить 1 атом H на CH₃ (рисунок ниже).

Структура каждого последующего гомолога может быть выведена из предыдущего таким же образом. В итоге из этана образуется пропан - C₃H₈.
Что такое изомеры?
Это вещества, которые имеют идентичный качественный и количественный молекулярный состав (идентичную молекулярную формулу), однако различное химическое строение, а также обладающие разными химсвойствами.
Вышерассмотренные углеводороды отличаются по такому параметру, как температура кипения: -0,5° - бутан, -10° - изобутан. Данный вид изомерии именуется как изомерия углеродистого скелета, она относится к структурному типу.
Число структурных изомеров растет быстрыми темпами с увеличением количества углеродных атомов. Таким образом, C₁₀H₂₂ будет соответствовать 75 изомерам (не включая пространственные), а для C₁₅H₃₂ уже известны 4347 изомеров, для C₂₀H₄₂ - 366 319.
Итак, уже стало понятно, что такое алканы, гомологический ряд, изомерия, номенклатура. Теперь стоит перейти к правилам составления названий по ИЮПАК.

Номенклатура ИЮПАК: правила образования названий
Во-первых, необходимо отыскать в углеводородной структуре углеродную цепь, которая наиболее длинна и содержит максимальное количество заместителей. Затем требуется пронумеровать атомы C цепи, начиная с конца, к которому ближе всего расположен заместитель.
Во-вторых, основа - название неразветвленного насыщенного углеводорода, которому по количеству атомов C соответствует самая главная цепь.
В-третьих, перед основой необходимо указать номера локантов, возле которых расположены заместители. За ними записываются через дефис названия заместителей.
В-четвертых, в случае наличия идентичных заместителей при разных атомах C локанты объединяются, при этом перед названием появляется умножающая приставка: ди - для двух идентичных заместителей, три - для трех, тетра - четырех, пента - для пяти и т. д. Цифры должны быть отделены друг от друга запятой, а от слов - дефисом.
Если один и тот же атом C содержится сразу два заместителя, локант тоже записывается дважды.
Согласно этим правилам и формируется международная номенклатура алканов.

Проекции Ньюмена
Этот американский ученый предложил для графической демонстрации конформаций специальные проекционные формулы - проекции Ньюмена. Они соответствуют формам А и Б и представлены на рисунке ниже.

В первом случае это А-заслоненная конформация, а во втором - Б-заторможенная. В позиции А атомы H располагаются на минимальном расстоянии друг от друга. Данной форме соответствует самое большое значение энергии, ввиду того что отталкивание между ними наибольшее. Это энергетически невыгодное состояние, вследствие чего молекула стремится покинуть его и перейти к более устойчивому положению Б. Здесь атомы H максимально удалены друг от друга. Так, энергетическая разница этих положений - 12 кДж/моль, благодаря чему свободное вращение вокруг оси в молекуле этана, которая соединяет метильные группы, получается неравномерным. После попадания в энергетически выгодное положение молекула там задерживается, другими словами, «тормозится». Именно поэтому оно и называется заторможенным. Результат - 10 тыс. молекул этана пребывают в заторможенной форме конформации при условии комнатной температуры. Только одна имеет другую форму - заслоненную.
Получение предельных углеводородов
Из статьи уже стало известно, что это алканы (строение, номенклатура их подробно описаны ранее). Будет нелишне рассмотреть способы их получения. Они выделяются из таких природных источников, как нефть, природный, каменный уголь. Применяются также и синтетические методы. Например, H₂ 2H₂:
- Процесс гидрирования CnH₂n (алкены)→ CnH₂n+2 (алканы)← CnH₂n-2 (алкины).
- Из смеси монооксида C и H - синтез-газа: nCO+(2n+1)H₂→ CnH₂n+2+nH₂O.
- Из карбоновых кислот (их солей): электролиз на аноде, на катоде:
- электролиз Кольбе: 2RCOONa+2H₂O→R-R+2CO₂+H₂+2NaOH;
- реакция Дюма (сплав со щелочью): CH₃COONa+NaOH (t)→CH₄+Na₂CO₃.
- Крекинг нефти: CnH₂n+2 (450-700°)→ CmH₂m+2+ Cn-mH₂(n-m).
- Газификация топлива (твердого): C+2H₂→CH₄.
- Синтез сложных алканов (галогенопроизводных), которые имеют меньшее количество атомов C: 2CH₃Cl (хлорметан) +2Na →CH₃- CH₃ (этан) +2NaCl.
- Разложение водой метанидов (карбидов металлов): Al₄C₃+12H₂O→4Al(OH₃)↓+3CH₄.
Физические свойства предельных углеводородов
Для удобства данные сгруппированы в таблицу.
Формула | Алкан | Температура плавления в °С | Температура кипения в °С | Плотность, г/мл |
0,415 при t = -165°С |
||||
0,561 при t= -100°C |
||||
0,583 при t = -45°C |
||||
0,579 при t =0°C |
||||
2-Метилпропан | 0,557 при t = -25°C |
|||
2,2-Диметил-пропан | ||||
2-Метилбутан | ||||
2-Метилпентан | ||||
2,2,3,3-Тетра-метилбутан | ||||
2,2,4-Триметил-пентан | ||||
н-C₁₀H₂₂ | ||||
н-C₁₁H₂₄ | н-Ундекан | |||
н-C₁₂H₂₆ | н-Додекан | |||
н-C₁₃H₂₈ | н-Тридекан | |||
н-C₁₄H₃₀ | н-Тетрадекан | |||
н-C₁₅H₃₂ | н-Пентадекан | |||
н-C₁₆H₃₄ | н-Гексадекан | |||
н-C₂₀H₄₂ | н-Эйкозан | |||
н-C₃₀H₆₂ | н-Триаконтан | 1 мм рт. ст | ||
н-C₄₀H₈₂ | н-Тетраконтан | 3 мм рт. ст. | ||
н-C₅₀H₁₀₂ | н-Пентаконтан | 15 мм рт. ст. | ||
н-C₆₀H₁₂₂ | н-Гексаконтан | |||
н-C₇₀H₁₄₂ | н-Гептаконтан | |||
н-C₁₀₀H₂₀₂ |
Заключение
В статье было рассмотрено такое понятие, как алканы (строение, номенклатура, изомерия, гомологический ряд и пр.). Немного рассказано об особенностиях радиальной и заместительной номенклатур. Описаны способы получения алканов.
Кроме того, в статье подробно перечислена вся номенклатура алканов (тест может помочь усвоить полученную информацию).
ОПРЕДЕЛЕНИЕ
Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только σ-связями.
В обычных условиях (при 25 o С и атмосферном давлении) первые четыре члена гомологического ряда алканов (C 1 — C 4) - газы. Нормальные алканы от пентана до гептадекана (С 5 - С 17) - жидкости, начиная с С 18 и выше - твердые вещества. По мере увеличения относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Строение молекулы алканов на примере метана приведено на рис. 1.
Рис. 1. Строение молекулы метана.
Алканы практически не растворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан, диэтиловый эфир и др.
Получение алканов
Основные источники различных предельных углеводородов, содержащих до 40 атомов углерода, — нефть и природный газ. Алканы с небольшим числом атомов углерода (1 - 10) можно выделить фракционной перегонкой природного газа или бензиновой фракции нефти.
Различают промышленные (I) и лабораторные (II) способы получения алканов.
C + H 2 → CH 4 (kat = Ni, t 0);
CO + 3H 2 → CH 4 + H 2 O (kat = Ni, t 0 = 200 - 300);
CO 2 + 4H 2 → CH 4 + 2H 2 O (kat, t 0).
— гидрирование непредельных углеводородов
CH 3 -CH=CH 2 + H 2 →CH 3 -CH 2 -CH 3 (kat = Ni, t 0);
— восстановление галогеналканов
C 2 H 5 I + HI →C 2 H 6 + I 2 (t 0);
— реакции щелочного плавления солей одноосновных органических кислот
C 2 H 5 -COONa + NaOH→ C 2 H 6 + Na 2 CO 3 (t 0);
— взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
2C 2 H 5 Br + 2Na → CH 3 -CH 2 -CH 2 -CH 3 + 2NaBr;
— электролиз солей одноосновных органических кислот
2C 2 H 5 COONa + 2H 2 O→H 2 + 2NaOH + C 4 H 10 + 2CO 2 ;
К(-): 2H 2 O + 2e → H 2 + 2OH — ;
A(+):2C 2 H 5 COO — -2e → 2C 2 H 5 COO + → 2C 2 H 5 + + 2CO 2 .
Химические свойства алканов
Алканы относятся к наименее реакционноспособным органическим соединениям, что объясняется их строением.
Алканы в обычных условиях не реагируют с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Для алканов наиболее характерны реакции, протекающие по радикальному механизму. Энергетически более выгоден гомолитический разрыв связей C-H и C-C, чем их гетеролитический разрыв.
Реакции радикального замещения наиболее легко протекают по третичному, дплее - по вторичному и в последнюю очередь по первичному атому углерода.
Все химические превращения алканов протекают с расщеплением:
1) cвязей C-H
— галогенирование (S R)
CH 4 + Cl 2 → CH 3 Cl + HCl (hv );
CH 3 -CH 2 -CH 3 + Br 2 → CH 3 -CHBr-CH 3 + HBr (hv ).
— нитрование (S R)
CH 3 -C(CH 3)H-CH 3 + HONO 2 (dilute) → CH 3 -C(NO 2)H-CH 3 + H 2 O (t 0).
— сульфохлорирование (S R)
R-H + SO 2 + Cl 2 → RSO 2 Cl + HCl (hv ).
— дегидрирование
CH 3 -CH 3 → CH 2 =CH 2 + H 2 (kat = Ni, t 0).
— дегидроциклизация
CH 3 (CH 2) 4 CH 3 → C 6 H 6 + 4H 2 (kat = Cr 2 O 3 , t 0).
2) связей C-H и C-C
— изомеризация (внутримолекулярная перегруппировка)
CH 3 -CH 2 -CH 2 -CH 3 →CH 3 -C(CH 3)H-CH 3 (kat=AlCl 3 , t 0).
— окисление
2CH 3 -CH 2 -CH 2 -CH 3 + 5O 2 → 4CH 3 COOH + 2H 2 O (t 0 , p);
C n H 2n+2 + (1,5n + 0,5)O 2 → nCO 2 + (n+1) H 2 O (t 0).
Применение алканов
Алканы нашли применение в различных отраслях промышленности. Рассмотрим подробнее, на примере некоторых представителей гомологического ряда, а также смесей алканов.
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений - спиртов, альдегидов, кислот. Пропан применяется как автомобильное топливо. Бутан используется для получения бутадиена, являющегося сырьем для производства синтетического каучука.
Смесь жидких и твердых алканов до С 25 , называемая вазелином применяется в медицине как основа мазей. Смесь твердых алканов С 18 - С 25 (парафин) применяется для пропитки различных материалов (бумага, ткани, древесина) для придания им гидрофобных свойств, т.е. несмачиваемости водой. В медицине используется для физиотерапевтическихпроцедур (парафинолечение).
Примеры решения задач
ПРИМЕР 1
| Задание | При хлорировании метана получено 1,54 г соединения, плотность паров по воздуху которого равна 5,31. Рассчитайте массу диоксида марганца MnO 2 , которая потребуется для получения хлора, если соотношение объемов метана и хлора, введенных в реакцию равно 1:2. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух - это смесь газов. Найдем молярную массу газа, образующегося при хлорировании метана: M gas = 29 ×D air (gas) = 29 × 5,31 = 154 г/моль. Это тетрахлорметан - CCl 4 . Запишем уравнение реакции и расставим стехиометрические коэффициенты: CH 4 + 4Cl 2 = CCl 4 + 4HCl. Рассчитаем количество вещества тетрахлорметана: n(CCl 4) = m(CCl 4) / M(CCl 4); n(CCl 4) = 1,54 / 154 = 0,01 моль. Согласно уравнению реакции n(CCl 4) : n(CH 4) = 1: 1, значит n(CH 4) = n(CCl 4) = 0,01 моль. Тогда, количество вещества хлора должно быть равно n(Cl 2) = 2 × 4 n(CH 4), т.е. n(Cl 2) = 8 × 0,01 = 0,08 моль. Запишем уравнение реакции получения хлора: MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O. Число моль диоксида марганца равно 0,08 моль, т.к. n(Cl 2) :n(MnO 2) = 1: 1. Найдем массу диоксида марганца: m(MnO 2) = n(MnO 2) ×M(MnO 2); M(MnO 2) = Ar(Mn) + 2×Ar(O) = 55 + 2×16 = 87 г/моль; m(MnO 2) = 0,08 × 87 = 10,4 г. |
| Ответ | Масса диоксида марганца равна 10,4 г. |
ПРИМЕР 2
| Задание | Установите молекулярную формулу трихлоралкана, массовая доля хлора в котором составляет 72,20%. Составьте структурные формулы всех возможных изомеров и дайте названия веществ по заместительной номенклатуре ИЮПАК. |
| Ответ | Запишем общую формулу трихлоралкеана:
C n H 2 n -1 Cl 3 . По формуле ω(Cl) = 3×Ar(Cl) / Mr(C n H 2 n -1 Cl 3) × 100% рассчитаем молекулярную массу трихлоралкана: Mr(C n H 2 n -1 Cl 3) = 3 × 35,5 / 72,20 × 100% = 147,5. Найдем значение n: 12n + 2n - 1 + 35,5×3 = 147,5; Следовательно, формула трихлоралкана C 3 H 5 Cl 3 . Составим структурные формулы изомеров: 1,2,3-трихлорпропан (1), 1,1,2-трихлорпропан (2), 1,1,3-трихлорпропан (3), 1,1,1-трихлорпропан (4) и 1,2,2-трихлорпропан (5). CH 2 Cl-CHCl-CH 2 Cl (1); CHCl 2 -CHCl-CH 3 (2); CHCl 2 -CH 2 -CH 2 Cl (3); CCl 3 -CH 2 -CH 3 (4); Алканами называют насыщенные углеводороды. В их молекулах атомы имеют одинарные связи. Структура определяется формулой CnH2n+2. Рассмотрим алканы: химические свойства, виды, применение. В структуре углерода есть четыре орбиты, по которым вращаются атомы. Орбитали обладают одинаковой формой, энергией.
Простая углеродная связь позволяет алкановым молекулам свободно вращаться, в результате чего структуры приобретают различные формы, образуя вершины при атомах углерода. Все алкановые соединения разделяются на две основные группы:
Виды алкановСуществует несколько видов алкановых соединений, каждой из которых имеет свою формулу, строение, химические свойства и алкильный заместитель. Таблица содержит гомологический ряд
Название алканов Общая формула насыщенных углеводородов — CnH2n+2. Изменяя значение n, получают соединение с простой межатомной связью. Полезное видео: алканы — строение молекул, физические свойства
Разновидности алканов, варианты реакцийВ естественных условиях алканы являются химически инертными соединения. Углеводороды не реагируют на контактирование с концентратом азотной и серной кислоты, щелочью и перманганатом калия. Одинарные молекулярные связи определяют реакции, характерные для алканов. Алкановые цепочки отличаются неполярной и слабо поляризуемой связью. Она несколько длиннее, нежели С-Н.
Общая формула алканов Реакция замещенияПарафиновые вещества отличаются незначительной химической активностью. Объясняется это повышенной прочностью цепной связи, которую непросто разорвать. Для разрушения используют гомологический механизм, в котором принимают участие свободные радикалы. Для алканов более естественны реакции замещения. Они не реагируют на молекулы воды и заряженные ионы. При замещении происходит замена водородных частиц галогеновыми и прочими активными элементами. Среди подобных процессов выделяют галогенирование, нитрирование и сульфохлорирование. Такие реакции используют для образования алкановых производных. Свободнорадикальное замещение происходит в три основных этапа:
ГалогенированиеПроцесс осуществляется по радикальному типу. Галогенирование происходит под воздействием ультрафиолета и температурного нагрева углеводородной и галогеновой смеси. Весь процесс происходит по правилу Марковникова. Суть его заключается в том, что первым галогенированию подвергается атом водорода, принадлежащий гидрированному углероду. Процесс начинается с третичного атома и заканчивается первичным углеродом. СульфохлорированиеДругое название – реакция Рида. Осуществляется она методом свободнорадикального замещения. Таким образом, алканы реагируют на действие комбинации серного диоксида и хлора под воздействием ультрафиолетового излучения. Реакция начинается с активизации цепного механизма. В это время из хлора выделяются два радикала. Действие одного направлено на алкан, в результате формируется молекула хлорводорода и алкильный элемент. Другой радикал соединяется с диоксидом серы, создавая сложную комбинацию. Для равновесия из другой молекулы отбирают один атом хлора. В итоге получают сульфонилхлорид алкана. Это вещество используют для выработки поверхностно-активных компонентов.
Сульфохлорирование НитрованиеПроцесс нитрования подразумевает соединение насыщенных углеродов с газообразным оксидом четырехвалентного азота и азотной кислотой, доведенной до 10% раствора. Для протекания реакции потребуется низкий уровень давления и высокая температура, приблизительно 104 градуса. В результате нитрования получают нитроалканы. ОтщеплениеПосредством отделения атомов проводят реакции дегидрирования. Молекулярная частица метана полностью разлагается под влиянием температуры. ДегидрированиеЕсли от углеродной решетки парафина (кроме метана) отделить атом водорода, образуются непредельные соединения. Эти реакции осуществляются в условиях значительных температурных режимов (400-600 градусов). Также используются различные металлические катализаторы. Получение алканов происходит путем проведения гидрирования непредельных углеводородов. Процесс разложенияПри влиянии температур во время алкановых реакций могут происходить разрывы молекулярных связей, выделение активных радикалов. Эти процессы известны под названием пиролиз и крекинг. При нагревании реакционного компонента до 500 градусов, молекулы начинают разлагаться, а на их месте формируются сложные радикальные алкильные смеси. Таким способом получают алканы и алкены в промышленности. ОкислениеЭто химические реакции, основанные на отдаче электронов. Для парафинов характерно автоокисление. В процессе используется окисление насыщенных углеводородов свободными радикалами. Алкановые соединения в жидком состоянии преобразуются в гидроперекись. Сначала парафин вступает в реакцию с кислородом. Образуются активные радикалы. Затем происходит реакция алкильной частицы со второй молекулой кислорода. Формируется перекисный радикал, который в последствие взаимодействует с алкановой молекулой. В результате процесса выделяется гидроперекись.
Реакция окисления алканов Применение алкановУглеродные соединения имеют широкое применение практически во всех основных сферах человеческой жизни. Некоторые из видов соединений являются незаменимыми для определенных отраслей производства и комфортного существования современного человека. Газообразные алканы – основа ценного топлива. Главным компонентом большинства газов является метан. Метан обладает способностью создавать и выделять большое количество тепла. Поэтому его в значительных объемах применяют в промышленности, для потребления в бытовых условиях. При смешивании бутана и пропана получают хорошее бытовое топливо. Метан используют при производстве таких продуктов:
Применение метана Жидкие углеводороды предназначены для создания топлива для двигателей и ракет, растворителей. Высшие углеводороды, где количество атомов углерода превышает 20, участвуют в производстве смазочных веществ, лакокрасочной продукции, мыла и моющих средств. Комбинация жирных углеводородов, в которых менее 15 атомов Н, являет собой вазелиновое масло. Эта безвкусная прозрачная жидкость применяется в косметике, в создании парфюмов, в медицинских целях. Вазелин – результат соединения твердых и жирных алканов с количеством атомов углерода меньше 25. Вещество участвует в создании медицинских мазей. Парафин, полученный в результате комбинирования твердых алканов, является твердой безвкусной массой, белого цвета и без аромата. Из вещества производят свечи, пропитывающую субстанцию для упаковочной бумаги и спичек. Также парафин популярен при осуществлении тепловых процедур в косметологии и медицине.
Галогенопроизводные алкановые соединения выполняют функции растворителей, хладагентов, а также основного вещества для дальнейшего синтеза. Полезное видео: алканы — химические свойства
ВыводАлканы являются ациклическими углеводородными соединениями, обладающими линейной или разветвленной структурой. Между атомами установлена одинарная связь, которая не поддается разрушению. Реакции алканов, основанные на замещении молекул, свойственные этому виду соединений. Гомологический ряд имеет общую структурную формулу CnH2n+2. Углеводороды относятся к насыщенному классу, поскольку содержат максимально допустимое количество атомов водорода. Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n - количество атомов углерода. Алканы - международное наименование данных соединений . Также эти соединения называют парафинами и насыщенными углеводородами. Связь в молекулах алканов простая (или одинарная). Остальные валентности насыщены атомами водорода. Все алканы насыщены водородом до предела, его атомы находятся в состоянии sp3-гибридизации. Гомологический ряд предельных углеводородов
С пятого алкана в гомологическом ряду названия соединений образуются следующим образом: греческое число, указывающее число атомов углеводорода в молекуле + окончание -ан. Так, по-гречески число 5 - пэндэ, соответственно за бутаном идет пентан - C5H12. Далее - гексан C6H14. гептан - C7H16, октан - C8H18, нонан - C9H20, декан - C10H22 и т. д. Физические свойства алканов заметно изменяются в гомологическом ряду: увеличивается температура плавления, кипения, увеличивается плотность. Метан, этан, пропан, бутан при обычных условиях, т. е. при температуре равной примерно 22 градуса тепла по Цельсию, являются газами, с пентана по гексадекан включительно - жидкостями, с гептадекана - твердыми веществами. Начиная с бутана, у алканов есть изомеры. Существуют таблицы, отражающие изменения в гомологическом ряду алканов , которые наглядно отражают их физические свойства. Номенклатура насыщенных углеводородов, их производные
Радикалы также образуются и неорганическими соединениям. Например, отняв у азотной кислоты гидроксильную группу ОН, можно получить одновалентный радикал -NO2, который называется нитрогруппой. При отрыве от молекулы алкана двух атомов водорода образуется двухвалентные радикалы, названия которых также образуются из названия соответствующих углеводородов, но окончание меняется на:
Алканы: химические свойстваРассмотрим реакции, характерные для алканов. Всем алканам присущи общие химические свойства. Данные вещества являются малоактивными. Все известные реакции с участием углеводородов подразделяются на два вида:
Очень активны в момент образования радикалы. Сами по себе они существуют доли секунды. Радикалы легко вступают в реакции между собой. Их неспаренные электроны образуют новую ковалентную связь. Пример: CH3 + CH3 → C2H6 Радикалы легко вступают в реакции с молекулами органических веществ. Они либо присоединяются к ним, либо отрывают от них атом с неспаренным электроном, в результате чего появляются новые радикалы, которые, в свою очередь, могут вступать в реакции с другими молекулами. При такой цепной реакции получаются макромолекулы, которые перестают расти только тогда, когда оборвется цепь (пример: соединение двух радикалов) Реакции свободных радикалов объясняют многие важные химические процессы, такие как:
Алканы могут гореть. Горит метан синеватым бледным пламенем. При этом результатом реакции будут оксид углерода и вода. При смешивании с воздухом, а также в смеси с кислородом, особенно если соотношение объемов будет 1:2, данные углеводород образует взрывчатые смеси, из-за чего он крайне опасен для применения в быту и шахтах. Если метан сгорает не полностью, то образуется сажа. В промышленности ее таким образом и получают. Из метана получают формальдегид и метиловый спирт путем его окисления в присутствии катализаторов. Если же метан сильно нагреть, то он распадается по формуле CH4 → C + 2H2 Распад метана можно осуществить до промежуточного продукта в специально оборудованных печах. Промежуточным продуктом будет ацетилен. Формула реакции 2CH4 → C2H2 + 3H2. Выделение ацетилена из метана сокращает расходы производства почти в два раза. Также из метана получают водород, производя конверсию метана с водяным паром. Характерными для метана являются реакции замещения. Так, при обычной температуре, на свету галогены (Cl, Br) по стадиям вытесняют водород из молекулы метана. Таким образом образуются вещества, называемые галогенопроизводными. Атомы хлора , замещая в молекуле углеводорода атомы водорода, образуют смесь разных соединений. В такой смеси присутствуют хлорметан (CH3 Cl или хлористый метил), дихлорметан (CH2Cl2или хлористый метилен), трихлорметан (CHCl3 или хлороформ), тетрахлорметан (CCl4 или четыреххлористый углерод). Любое из этих соединений может быть выделено из смеси. В производстве важное значение отводится хлороформу и тетрахлорметану, в силу того, что они являются растворителями органических соединений (жиров, смол, каучука). Галогенопроизводные метана образуются по цепному свободнорадикальному механизму. Свет воздействует на молекулы хлора, вследствие чего они распадаются на неорганические радикалы, которые отрывают атом водорода с одним электроном от молекулы метана. При этом образуется HCl и метил. Метил реагирует с молекулой хлора, в результате чего получается галогенопроизводное и радикал хлора. Далее радикал хлора продолжает цепную реакцию. При обычной температуре метан обладает достаточной стойкостью к щелочам, кислотам, многим окислителям. Исключение - азотная кислота. В реакции с ней образуется нитрометан и вода. Реакции присоединения для метана не характерны, т. к. все валентности в его молекуле насыщены. Реакции, в которых участвуют углеводороды могут проходить не только с расщеплением связи С-Н, но и с разрывом связи С-С. Такие превращения происходят при наличии высоких температур и катализаторов. К таким реакциям относятся дегидрогенизация и крекинг. Из насыщенных углеводородов путем окисления получают кислоты - уксусную (из бутана), жирные кислоты (из парафина). Получение метана
В условиях лаборатории данный газ выделяют при нагревании смеси ацетат натрия + гидроксид натрия, а также реакцией карбида алюминия и воды. Также метан получают из простых веществ. Для этого обязательными условиями являются нагрев и катализатор. Промышленное значение имеет получение метана синтезом на основе водяного пара. Метан и его гомологи могут быть получены при прокаливании солей соответствующих органических кислот с щелочами. Еще одним способом получения алканов является реакция Вюрца, при которой нагреваются моногалогенопроизводные с металлическим натрием.
|






 Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан - C2H6, пропан C3H8, бутан - C4H10.
Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан - C2H6, пропан C3H8, бутан - C4H10. Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана - этил, из пропана - пропил и т. д.
Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана - этил, из пропана - пропил и т. д. Подробно можно рассмотреть химические свойства
насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации, и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Подробно можно рассмотреть химические свойства
насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации, и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим. В природе метан
распространен достаточно широко. Он - главная составная часть большинства горючих природных и
В природе метан
распространен достаточно широко. Он - главная составная часть большинства горючих природных и